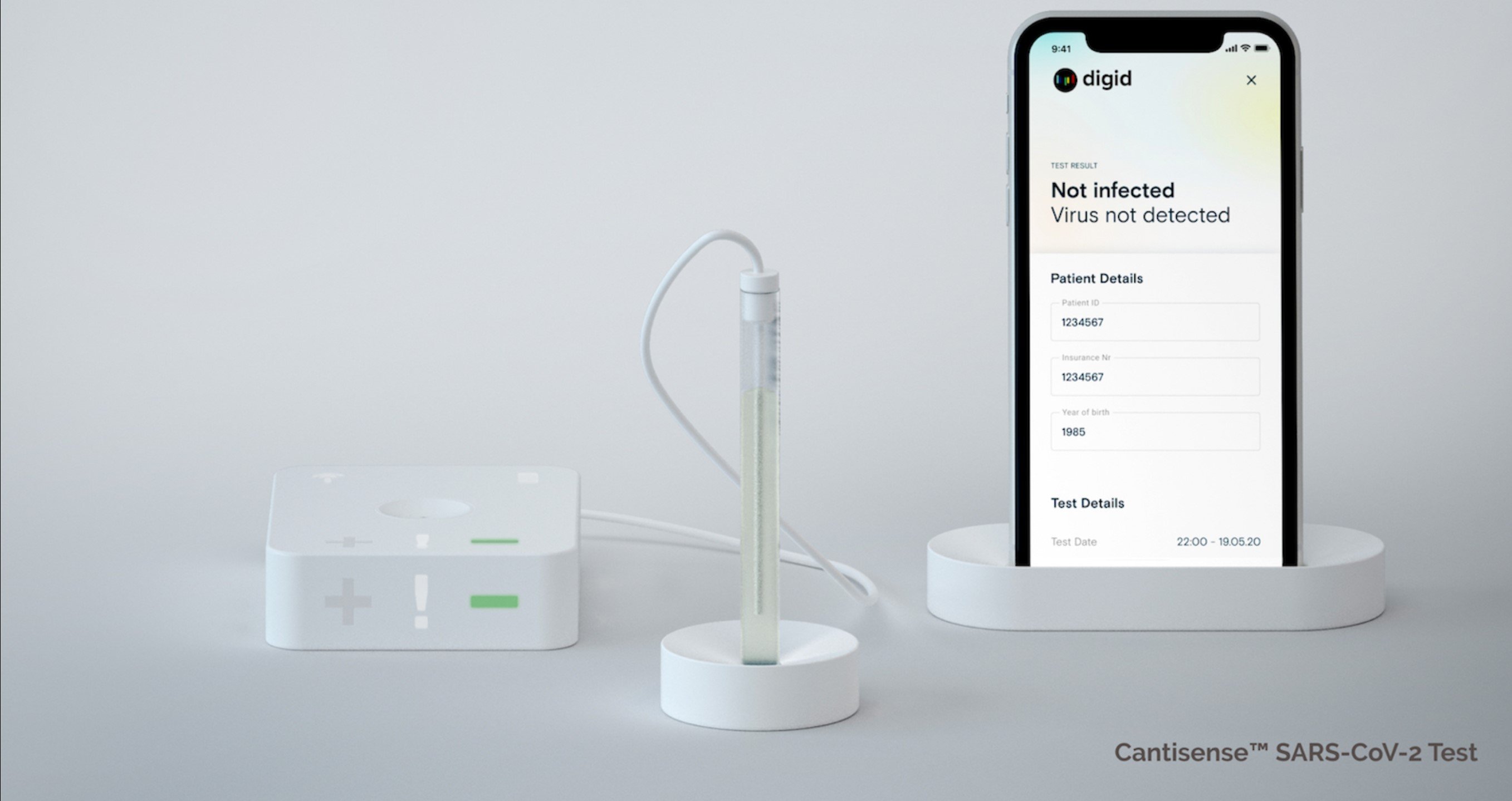
Mainz - (ots) - Das Gesundheitstechnologie-Unternehmen Digital Diagnostics AG hat beim Zulassung für ersten Corona Antigen-Schnelltest in Deutschland die Zulassung des Digid Cantisense(TM) SARS-CoV-2 Tests für Deutschland beantragt.
Mit dem neuen Test können am Point-of-Care in wenigen Minuten SARS-CoV-2 Viren mit hoher Messgenauigkeit direkt in Testflüssigkeiten nachgewiesen werden.
Im Gegensatz zu den PCR-Verfahren
kann der neue Antigen-Test innerhalb weniger Minuten eine eindeutige
elektronische "JA"- oder "NEIN"-Information liefern und erspart
wertvolle Zeit bei der Diagnose.
Darüber hinaus weist der Digid Cantisense(TM) SARS-CoV-2 Test das Vorhandensein des Virus direkt nach, während andere Schnelltests nur Antikörper erkennen. Diese entwickelt der Patient aber erst, wenn er bereits mehrere Tage lang infiziert und bereits ansteckend war. Deshalb eignen sich Antikörper-Schnelltests nur bedingt, um die Ausbreitung der Pandemie einzudämmen.
Der Digid Cantisense(TM) SARS-CoV-2 Test ermöglicht dagegen die einfache und schnelle Testung von Patienten und medizinischem Personal vor Ort ohne den zeitaufwändigen Umweg über ein Labor und identifiziert innerhalb weniger Minuten infizierte Personen. Zu den möglichen Einsatzgebieten zählen deshalb u.a. Zugangskontrollen an Flughäfen und Bahnhöfen, Krankenhäusern und speziell geschützten Bereichen (Alten- und Pflegeheime) sowie für Unternehmen, die sicherstellen wollen, dass ihre Produktion störungsfrei und sicher läuft.
Digital Diagnostics hatte bereits letzte Woche die Zulassung ihres Antigentests bei der US-Arzneimittelbehörde FDA beantragt, nachdem im Rahmen von Versuchen im Hochsicherheitslabor des Helmholtz-Zentrums für Infektionsforschung (HZI) in Braunschweig erstmals mit der Cantisense(TM) Technologie erfolgreich SARS-CoV-2 Viren nachgewiesen werden konnten.
Diese Technologie beruht auf Cantilever, die in einem Mikrochip integriert sind. Die nanomechanischen Federbalken aus Silizium sind extrem dünn und mit einer Fangschicht aus hoch spezifischen monoklonalen Antikörpern beschichtet. Diese Antikörper binden die Viren, die mit der Testflüssigkeit auf den Chip aufgetragen werden. Wenn das neue Coronavirus an die Fangschicht bindet, führt dies durch Veränderungen der Oberflächenspannung zu einer mechanischen Biegung, die ein elektrisches Signal am Chip erzeugt.
Das erzielte Messergebnis wird bei der Point-of-Care Lösung drahtlos von einem Sensor-Hub zu einem mobilen Endgerät übertragen. Durch die Anbindung an eine sichere Analyseplattform können die zahlreichen Sensordaten mit weiteren Daten verknüpft und anonym für Forschungs- und Diagnostik-Zwecke weiterverarbeitet werden.
In einem nächsten Schritt wird das Unternehmen mit ihrem Antigentest die erforderlichen klinischen Studien durchführen. Zu diesem Zweck wurden bereits internationale Kooperationen mit führenden Krankenhäusern in Europa, Afrika und Asien vereinbart.
Ziel ist es, nach der Zulassung
durch BfArM und FDA, die in den nächsten Wochen erwartet wird, die Tests
in Millionen-Stückzahl auf den Markt zu bringen. Kurzfristig ist mit
Produktionspartnern in den USA und in Europa eine weitere Skalierung der
Kapazitäten geplant. Die Experten von Digital Diagnostics arbeiten
darüber hinaus unter Hochdruck an der Weiterentwicklung der Technologie
und an der Adaption des Point-of-Care-Testverfahrens, damit dieses
perspektivisch auch von Privatpersonen zu Hause eingesetzt werden kann.
Text und Foto: "obs/Digital Diagnostics AG"
Bildrechte: Digital Diagnostics AG
Fotograf: Digital Diagnostics