Eine nachhaltigere Nutzung chemischer Ressourcen ist Teil der Agenda 2030 der Vereinten Nationen. Synthetische Chemiker arbeiten daher daran, effiziente Synthesen zu entwerfen und durchzuführen. Innerhalb des synthetischen Arsenals des organischen Chemikers spielen Prozesse eine zentrale Rolle, die mehrere Moleküle (Kupplungspartner) in einem einzigen Schritt verknüpfen – sogenannte Mehrkomponentenreaktionen (MCR). Diese gelten als nachhaltige und umweltfreundliche Technologien für die schnelle Herstellung komplexer Strukturen und Arzneimittel in einem einzigen Reaktionsschritt. Ein Forscherteam um Chemieprofessor Dr. Frank Glorius (Westfälische Wilhelms-Universität Münster) und Dr. Huan-Ming Huang (WWU Münster und ShanghaiTech University) hat es nun erstmals geschafft, sogenannte Ketylradikale für eine neuartige MCR zu nutzen. Diese Studie wurde in der kürzlich gegründeten Fachzeitschrift Nature Synthesis veröffentlicht.
„Ketylradikale sind sehr wichtige Spezies in der synthetischen Chemie. Sie werden häufig bei der Herstellung von strukturell komplexen Naturstoffen eingesetzt. Katalytische chemische Umwandlungen, die Ketylradikale nutzen, sind jedoch nach wie vor eine Herausforderung. Ihre Bildung erfordert oft ‚harsche‘ Reaktionsbedingungen mit einer hohen Temperatur. Die Radikale können in ihren Reaktionswegen außerdem unselektiv sein, also schwer zu steuern", erklärt Huan-Ming Huang.
Das Forscherteam setzte Ketylradikale und eine durch sichtbares Licht angeregte Palladiumkatalyse ein und schuf so eine MCR zwischen mehreren Kupplungspartnern. Bei der Auswahl der Kupplungspartner (Aldehyde, 1,3-Diene und verschiedene Nukleophile) berücksichtigten die Forscher verschiedene Aspekte: Welche Substanzen sind nötig, damit die Reaktion stattfinden kann, welche sind leicht verfügbar und welche Produkte sind nützlich?
"Es ist uns gelungen, Radikale des Ketyltyps zu zähmen, indem wir sichtbares Licht mit geringen Mengen eines handelsüblichen Palladiumkatalysators kombiniert haben", betont Mitautor Peter Bellotti. "Dieser operativ einfache, redoxneutrale und damit umweltfreundliche Ansatz könnte sich zu einer allgemeinen Plattform für die Konstruktion sogenannter komplexer homoallylischer Alkoholmotive, einem in der Synthesechemie häufig verwendeten Strukturmotiv, entwickeln. Die einstufige Synthese von wichtigen Intermediaten, die weiter zu wertvollen Produkten umgesetzt werden können, ist der Beweis für die Vielseitigkeit dieses Ansatzes."
Zusätzlich zu den synthetischen Möglichkeiten dieser Methode untersuchte das Team die mechanistischen Feinheiten mittels einer kombinierten experimentellen mechanistischen Analyse und Dichtefunktionaltheorie (DFT)-Berechnungen.
"Wir gehen davon aus, dass die Kombination von sichtbarem Licht mit Übergangsmetallen wie Palladium weitere unvorhergesehene synthetische Umwandlungen jenseits der etablierten katalysierten Reaktionen inspirieren könnte", bilanziert Frank Glorius.
WWU
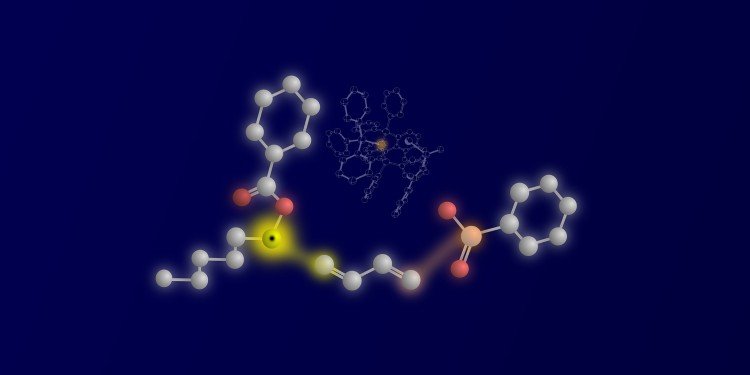
Bild: Die drei Reaktionspartner und ihre Verknüpfung: links das ketylartige Radikal, in der Mitte das 1,3-Dien und rechts das nukleophile Sulfinat. Die reaktiven Atome und die sich bildende Bindung sind gelb (Ketylkohlenstoff und erste C-C-Bindung) und orange (Schwefelnukleophil-Atom und zweite C-S-Bindung) hervorgehoben. Im Hintergrund ist der katalytisch aktive Palladiumkomplex mit dem orangefarbenen Palladiumzentrum zu sehen / © WWU – Peter Bellotti