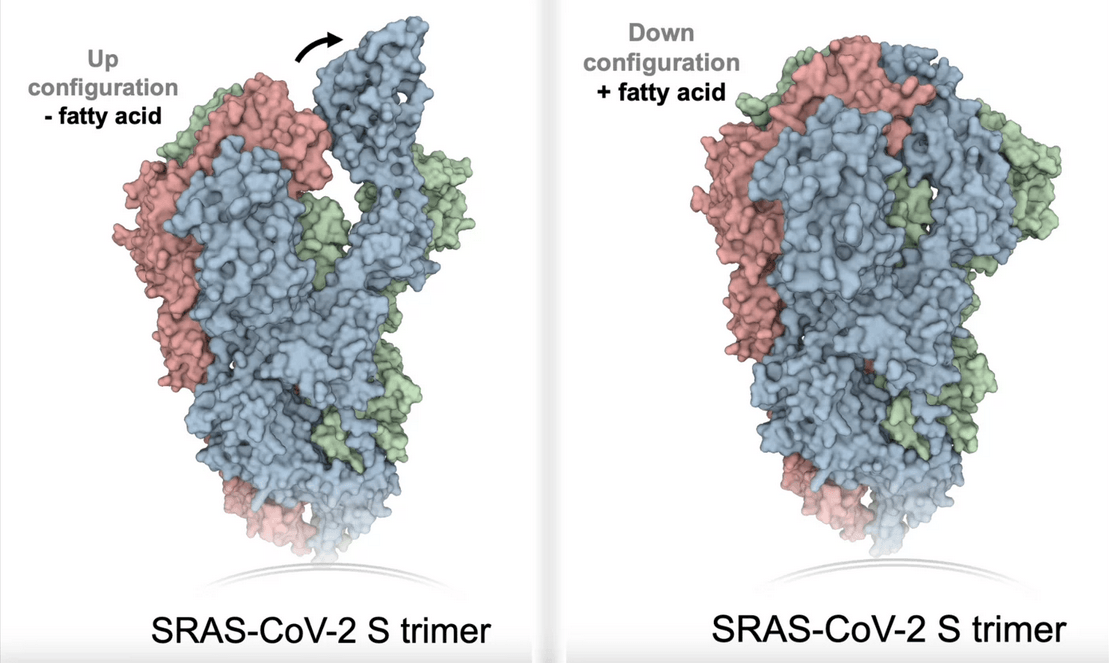
Faltmechanismus des Spike-Proteins nach Bindung einer Fettsäure während einer Entzündung.
© Oskar Staufer
Entgeht das Spike-Protein dem Immunsystem dank eines Faltmechanismus?
In einem nächsten Schritt verwendeten die Wissenschaftlerinnen und Wissenschaftler die künstlichen Virionen um die Wirkung von bestimmten Fettsäuren auf das Spike-Protein von Sars-CoV-2 zu untersuchen. Diese Fettsäuren werden bei jeder Entzündung im Körper freigesetzt und helfen, die Immunantwort und Heilungsprozesse zu steuern.
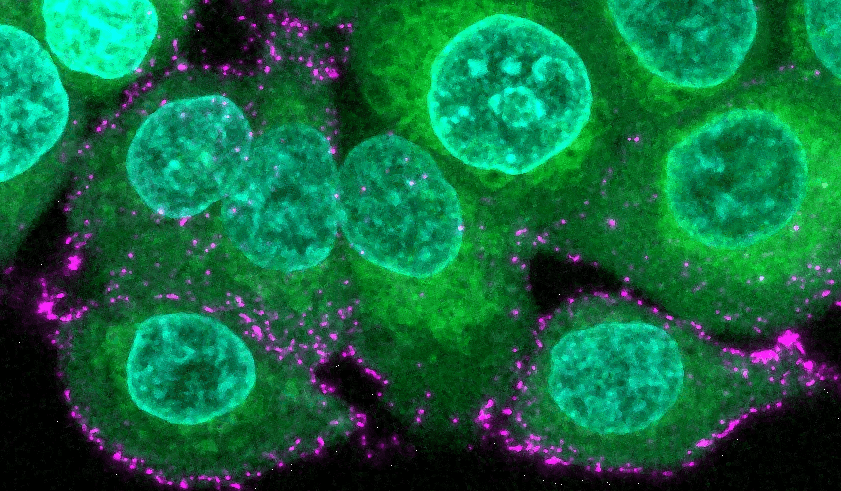
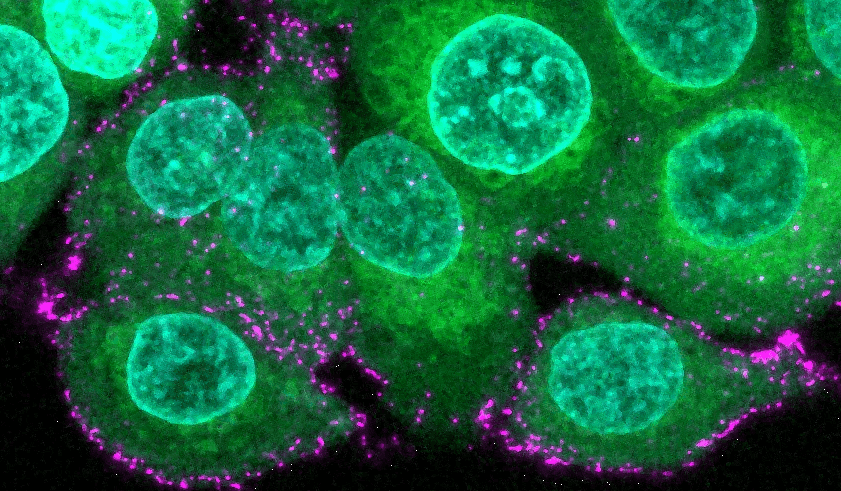
Menschliche Epithelzellen (grün mit blauen Kernen) werden mit synthetischen Sars-CoV-2-Viren (magenta) inkubiert, um den Beginn der Infektion und die Immunabwehr zu untersuchen.
© Max-Planck-Institut für medizinische Forschung / Oskar Staufer
Ist das das Geheimnis des Corona-Virus?
Das Spike-Protein ist entscheidend für die Wirt-Virus-Interaktion. Einerseits nutzt das Virus das Spike-Protein, um an die ACE2-Rezeptoren der Wirtszellen zu binden. Dadurch kann das Virus mit der Wirtszelle verschmelzen und seine Erbinformation freisetzen. Andererseits können vom Wirt produzierte Antikörper an das Spike-Protein binden und so das Virus als Angriffspunkt für das Immunsystem markieren.
Bisher war bekannt, dass das Spike-Protein eine bestimmte Region besitzt, in der Fettsäuren binden können. Die Funktion dieser Bindungstasche war jedoch noch unbekannt. Forschende des Max-Planck-Instituts für medizinische Forschung und Kollegen in Bristol nutzten nun die künstlichen Sars-CoV-2-Virionen, um genau diesen Mechanismus zu untersuchen. Sie zeigten, dass das Spike-Protein bei der Bindung einer Fettsäure seine Form ändert und sich „zusammenfaltet“. Dadurch ist eine Bindung an den ACE2-Rezeptor des Wirts nicht mehr möglich und es können weniger Antikörper an das Protein binden.
Die Wissenschaftlerinnen und Wissenschaftler können nun erforschen, warum dieser Faltmechanismus vom Virus verwendet wird, und feststellen, ob diese Informationen zur Entwicklung therapeutischer Strategien verwendet werden können. „Durch das „Zusammenfalten“ des Spike-Proteins bei der Bindung von Fettsäuren wird das Virus für das Immunsystem weniger „sichtbar“.
Dies könnte ein Mechanismus sein, um eine Erkennung durch den Wirt und eine starke Immunantwort über einen längeren Zeitraum zu vermeiden und die Effizienz der Infektion insgesamt zu erhöhen“, sagt Oskar Staufer. Die Forschung steht hier erst am Anfang, aber die Verwendung künstlicher Virionen bietet eine neue Möglichkeit, die Funktion des Faltmechanismus aufzuklären. „Solche Konzepte der Synthetischen Biologie auf ein Problem mit globaler Tragweite anzuwenden, ist wirklich spannend!“, sagt Oskar Staufer.
Das Max Planck-Bristol Centre for Minimal BiologyDas gemeinsame Forschungszentrum der Max-Planck-Gesellschaft und der Universität Bristol konzentriert sich auf das Gebiet der synthetischen und minimalen Biologie. Hier wollen Forschende künstliche Zellen und Zytoskelette konstruieren und molekulare Maschinen im Nanomaßstab entwickeln, um die für das Leben notwendigen Bausteine zu untersuchen. Die enge Zusammenarbeit hat in der Vergangenheit zu vielen spannenden Erkenntnissen geführt und bietet ein großes Potenzial, sich optimal zu ergänzen, um in Zukunft weitere wissenschaftliche Fortschritte zu machen
© Max-Planck-Institut für medizinische Forschung / Oskar Staufer