Einige der bekanntesten menschlichen Krankheitserreger – vom Pestbakterium Yersinia pestis bis zum Durchfallerreger Salmonella – nutzen eine winzige Injektionsnadel, um krankmachende Proteine in die Zellen ihres Wirts zu injizieren und diese so zu manipulieren. Diese Nadel ist Teil des sogenannten T*p III-Sekretionssystems (T3SS), ohne das die meisten dieser Krankheitserreger sich nicht im Körper vermehren könnten.
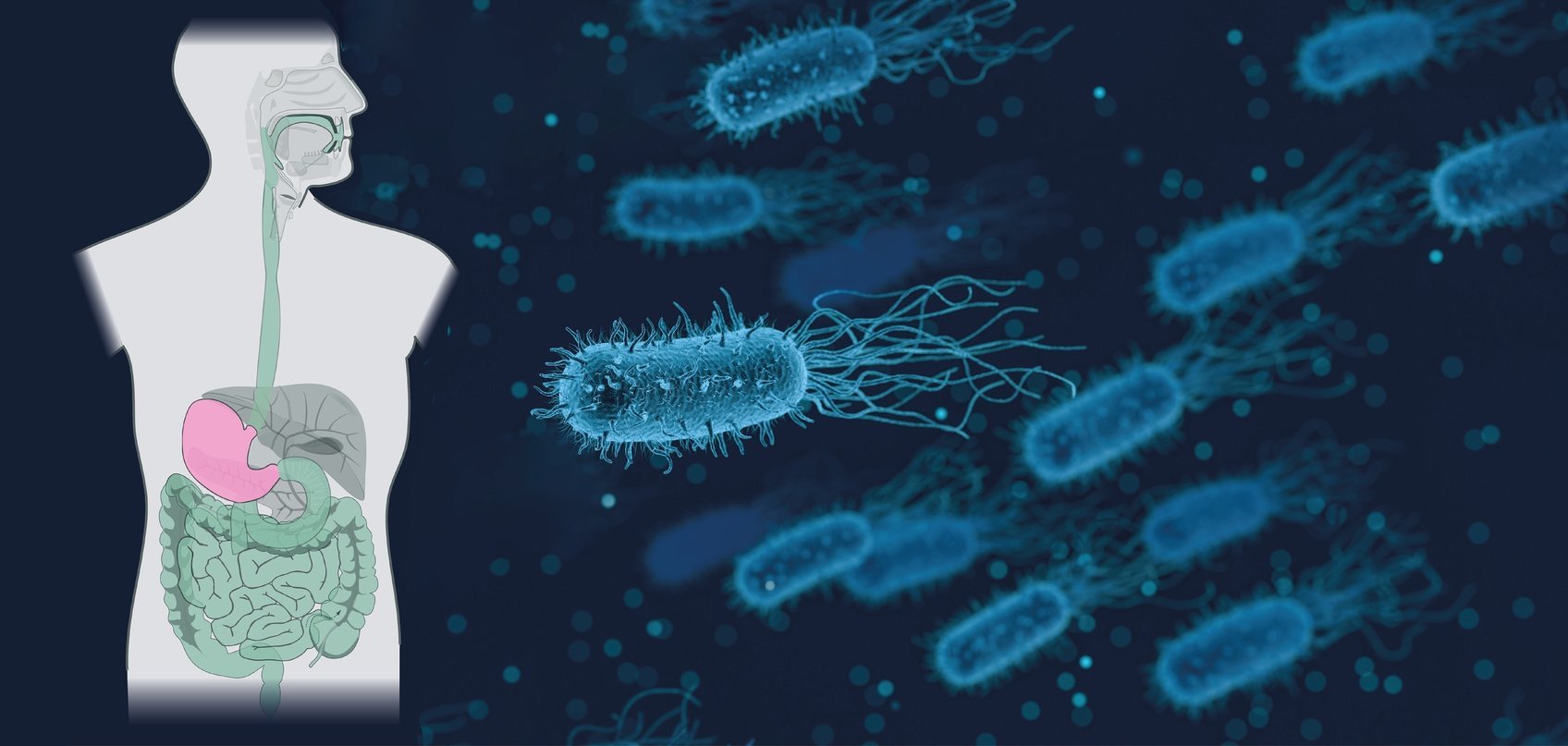
Der Verdauungstrakt - ein Wechselbad für Bakterien
Vor Kurzem wurde entdeckt, dass große Teile des T3SS nicht fest an dem Hauptteil des Systems verankert sind, sondern sich während der Funktion beständig austauschen. Die Bedeutung dieses „Reifenwechsels am fahrenden Wagen“ war bisher aber unbekannt. Ein Team um Andreas Diepold am Max-Planck-Institut für terrestrische Mikrobiologie haben nun herausgefunden, dass die Dynamik der Maschine es den Bakterien erlaubt, Aufbau und Funktion des Injektionsapparats schnell an die äußeren Bedingungen anzupassen.
Diese haben es in sich: Der Verdauungstrakt des Menschen startet mit neutralem bis leicht basischen Milieu im Mund und Speiseröhre, bis sie im Magen dank der Magensäure schlagartig zu stark sauer wechselt – eine Umgebung, die viele Krankheitserreger nicht überleben. Das eigentliche Angriffsziel von Yersinia enterocolitica, der in der Studie untersuchten Bakterienart, ist der Darm. Hier herrschen wieder pH-neutrale Bedingungen.
Doch wie schaffen es die Bakterien, sich so schnell an die wechselnden Bedingungen anzupassen, und wie wird diese gesteuert? Doktorand Stephan Wimmi, der Erstautor der Studie, konnte nachweisen, dass ein Protein in der Membran der Bakterien als Sensor für den pH-Wert fungiert. In einer Kollaboration mit dem Labor von Ulrike Endesfelder am Max-Planck-Institut fand er heraus, dass dieses Protein bei niedrigem (= saurem) pH beweglicher wird und so das Signal an die T3SS-Bestandteile im Inneren des Bakteriums weitergibt.
Flexibilität statt Fehlzündung
In einer sauren Umgebung wie die des Magens binden demnach die beweglichen Komponenten nicht an den Rest der Maschine (inklusive der Nadel selbst), so dass das Injektionssystem inaktiv bleibt. Sobald die Bakterien in eine pH-neutrale Umgebung gelangen, wie sie im Darm vorherrscht, bauen sich die dynamischen Proteine wieder zusammen, so dass das T3SS an diesen Orten schnell aktiv werden kann - zum möglichen Leidwesen der infizierten Person.
Die Forscherinnen und Forscher spekulieren, dass der neu entdeckte Effekt es den Bakterien erlauben könnte, eine energieaufwendige „Fehlzündung“ des Sekretionssystems in der falschen Umgebung zu verhindern, welche unter Umständen sogar die Immunantwort des Wirts aktivieren könnte. Auf der anderen Seite erlaubt es die Beweglichkeit und Dynamik der Struktur, das System unter geeigneten Bedingungen schnell wiederaufzubauen und zu aktivieren.
Beweglichkeit und Austausch von Proteinen wird in immer mehr Komplexen und Nanomaschinen in allen Domänen des Lebens entdeckt; der Nutzen dieser Dynamik ist allerdings meist unverstanden. Die neuen Ergebnisse aus Marburg zeigen, wie der Austausch von Proteinen genutzt werden kann, um flexibel auf äußere Umstände zu reagieren – ein immenser Vorteil, nicht nur für Bakterien.
Max Planck Gesellschaft
Grafik: MPI f. terrestrische Mikrobiologie/ Diepold