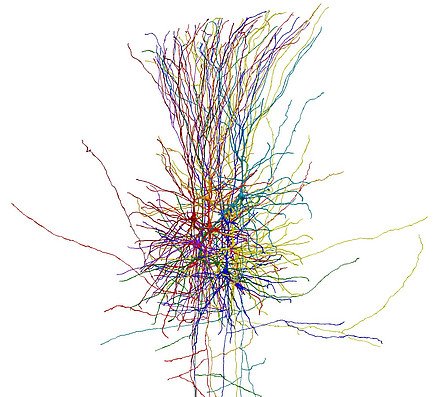
Entgegen bisherigen Annahmen sind Nervenzellen in der menschlichen Hirnrinde anders verschaltet als bei der Maus. Das ist das Ergebnis einer Studie der Charité – Universitätsmedizin Berlin, die jetzt im Fachmagazin Science* erschienen ist. Danach kommunizieren die Neurone beim Menschen in eine Richtung, während die Signale bei der Maus häufiger in Schleifen fließen. Das macht die Informationsverarbeitung beim Menschen leistungsfähiger und effizienter. Die Erkenntnisse könnten zur Weiterentwicklung künstlicher neuronaler Netzwerke beitragen.
Weniger als fünf Millimeter dick ist die Großhirnrinde, eine der wichtigsten Strukturen für die menschliche Intelligenz. Zwanzig Milliarden Nervenzellen verarbeiten hier, in der äußersten Schicht des Gehirns, unzählige Sinneswahrnehmungen. In der Hirnrinde planen wir Handlungen, hier sitzt unser Bewusstsein. Wie gelingt es den Nervenzellen, diese komplexen Informationen zu verarbeiten? Das hängt maßgeblich davon ab, wie sie miteinander verschaltet sind.
Anzeige
Komplexere Hirnrinde – andere Informationsverarbeitung
„Unser bisheriges Verständnis der neuronalen Architektur in der Großhirnrinde basiert größtenteils auf Erkenntnissen, die an Tiermodellen wie der Maus gewonnen wurden“, erklärt Prof. Jörg Geiger, Direktor des Instituts für Neurophysiologie der Charité. „Bei ihnen kommunizieren die benachbarten Nervenzellen häufig wie in einem wechselseitigen Dialog miteinander, ein Neuron funkt ein anderes an und dieses sendet wieder ein Signal zurück. Dadurch fließen die Informationen oft in Schleifen.“
Die menschliche Großhirnrinde ist deutlich größer und auch komplexer als bei der Maus. Trotzdem hat man bisher – auch aufgrund fehlender Daten – angenommen, dass sie nach denselben Verschaltungsprinzipien funktioniert. Dass dem nicht so ist, konnte ein Charité-Forschungsteam um Jörg Geiger anhand von besonders rarem Probenmaterial und unter Einsatz modernster Technik jetzt belegen.
Ein ausgeklügeltes Verfahren, um neuronale Kommunikation abzuhören
Für die Studie untersuchten die Forschenden Hirngewebe von 23 Menschen, die sich aufgrund einer Epilepsie einer neurochirurgischen Operation an der Charité unterzogen hatten. Im Zuge des Eingriffs war Hirngewebe entfernt worden, um Zugang zu den darunter liegenden erkrankten Strukturen zu erhalten. Die Patient:innen hatten der Nutzung dieses Gewebes für die Forschung zugestimmt.
Um die Signalflüsse zwischen benachbarten Neuronen in der äußersten Schicht der menschlichen Großhirnrinde beobachten zu können, entwickelte das Team eine verbesserte Variante der sogenannten Multipatch-Technik. Sie erlaubte den Forschenden, der Kommunikation von bis zu zehn Nervenzellen gleichzeitig zu lauschen (Details in „Über die Methodik“). Dadurch gelang es ihnen, in der kurzen Zeit, bis die Zellen außerhalb des Körpers ihre Aktivität einstellen, die für die Erstellung einer Netzwerkkarte nötige Anzahl an Messungen durchzuführen. Insgesamt analysierten sie so die Kommunikationswege von knapp 1.170 Nervenzellen mit rund 7.200 möglichen Verbindungen.

Geradeaus statt in Schleifen Das Ergebnis: Nur ein kleiner Bruchteil der Neurone führte wechselseitige Dialoge. „Beim Menschen fließen die Informationen stattdessen vorrangig in eine Richtung, sie kehren nur selten direkt oder über Schleifen an den Ausgangspunkt zurück“, erklärt Dr. Yangfan Peng, Erstautor der Publikation. Der Wissenschaftler arbeitete am Institut für Neurophysiologie an der Studie und ist inzwischen an der Klinik für Neurologie und dem Neurowissenschaftlichen Forschungszentrum der Charité tätig. Dass dieser vorwärts gerichtete Signalfluss Vorteile für die Datenverarbeitung mit sich bringt, konnten die Wissenschaftler:innen anhand einer Computersimulation belegen, die sie nach den Prinzipien der menschlichen Netzwerk-Architektur erstellten.
Die Forschenden gaben dem künstlichen neuronalen Netzwerk eine typische Aufgabe des maschinellen Lernens: Es sollte Audio-Aufnahmen von Zahlwörtern erkennen und ihnen die richtige Ziffer zuweisen. Es zeigte sich, dass das dem Menschen nachempfundene Modell bei dieser Spracherkennung häufiger richtig lag als ein der Maus nachempfundenes. Es war außerdem effizienter: Umgerechnet wären für dieselbe Leistung 380 Nervenzellen bei der Maus, aber nur 150 Nervenzellen beim Menschen nötig.
Ökonomisches Vorbild für KI?
„Die gerichtete Netzwerk-Architektur beim Menschen ist leistungsfähiger und ressourcenschonender, weil mehr unabhängige Nervenzellen gleichzeitig unterschiedliche Aufgaben bewältigen können“, erklärt Yangfan Peng. „Das Netzwerk kann also mehr Informationen speichern. Unklar ist noch, ob unsere in der äußersten Schicht der Hirnrinde gesammelten Ergebnisse für die gesamte Hirnrinde gelten und wie gut sie die einzigartigen kognitiven Fähigkeiten des Menschen erklären können.“
Für die Konstruktion künstlicher neuronaler Netzwerke haben sich KI-Entwickler in der Vergangenheit von biologischen Vorbildern inspirieren lassen, sie optimierten die Algorithmen aber auch unabhängig von der Biologie. „Viele künstliche neuronale Netzwerke nutzen bereits eine Form der vorwärts gerichteten Struktur, weil diese bei manchen Aufgaben bessere Ergebnisse liefert“, sagt Jörg Geiger. „Es ist faszinierend zu sehen, dass auch das menschliche Hirn verwandte Verschaltungsprinzipien aufweist. Die Erkenntnisse, die wir jetzt zu der besonders ressourcenschonenden Informationsverarbeitung in der menschlichen Hirnrinde gesammelt haben, könnten nun zur Verfeinerung der KI-Netzwerke beitragen.“
*Peng Y et al. Directed and acyclic synaptic connectivity in the human layer 2-3 cortical microcircuit. Science 2024 Apr 18. doi: 10.1126/science.adg8828
Über die Studie
Die Arbeit ist entstanden in enger Zusammenarbeit zwischen den grundlagenwissenschaftlichen und den klinischen Bereichen der Charité. Unter Leitung des Instituts für Neurophysiologie waren involviert: die Klinik für Neurochirurgie, die Klinik für Neurologie mit Experimenteller Neurologie, das Institut für Integrative Neuroanatomie, das Institut für Neuropathologie, das Neurowissenschaftliche Forschungszentrum und das Exzellenzcluster NeuroCure, unterstützt durch die Universitätsklinik für Neurochirurgie des Evangelischen Klinikums Bethel sowie das Institut für Neuroinformatik der ETH Zürich.
Über die Methodik
Bei einer operativen Behandlung von therapie-refraktären Epilepsien ist es in vielen Fällen medizinisch notwendig, Hirngewebe zu entfernen. Voraussetzung für die Untersuchung dieses wertvollen Gewebes in der nun veröffentlichten Studie war die explizite Einwilligung der Patient:innen, für die sich die Forschungsgruppe ausdrücklich bedankt. Für die Analyse der synaptischen Kommunikation zwischen den Neuronen nutzten die Autoren die sogenannte Patch-Clamp-Methode. Dabei wird unter dem Mikroskop eine sehr feine Glaspipette an eine einzelne Nervenzelle angedockt, um deren elektrische Aktivität zu messen oder sie zu stimulieren. In der Studie kam eine Weiterentwicklung der Technik zum Einsatz, bei der mehrere dieser Glaspipetten gleichzeitig die Aktivität und Konnektivität von zehn Nervenzellen aufzeichnen (Multipatch-Verfahren). Um die Glaspipetten präzise positionieren zu können, ist das Gerät mit Roboterarmen ausgestattet, die Bewegungen im Nanometerbereich ermöglichen. Die Messung ist sehr anspruchsvoll und aufwendig, durch die Nutzung von zwei Geräten parallel gelang es dem Team, pro Gewebe mehrere Hundert Verbindungen zwischen den Nervenzellen zu untersuchen. Das Hirngewebe kann in einer künstlichen Nährlösung bis zu zwei Tage außerhalb des Körpers überdauern, bevor es seine Aktivität einstellt.
Charité – Universitätsmedizin Berlin
Anzeige